Qu'est-ce que l'oxygène dissous ?
L'oxygène dissous (OD) désigne l'oxygène moléculaire (O₂).₂) qui est dissous dans l'eau. Il diffère des atomes d'oxygène présents dans les molécules d'eau (H₂L'oxygène dissous (OD), présent dans l'eau sous forme de molécules indépendantes, provient soit de l'atmosphère, soit de la photosynthèse des plantes aquatiques. Sa concentration est influencée par divers facteurs, tels que la température, la salinité, le débit de l'eau et l'activité biologique. De ce fait, il constitue un indicateur essentiel pour évaluer l'état de santé et de pollution des milieux aquatiques.
L'oxygène dissous joue un rôle essentiel dans le métabolisme microbien, influençant la respiration cellulaire, la croissance et la biosynthèse des métabolites. Cependant, des concentrations élevées d'oxygène dissous ne sont pas toujours bénéfiques. Un excès d'oxygène peut entraîner une surproduction de métabolites accumulés et potentiellement provoquer des réactions toxiques. Les concentrations optimales d'oxygène dissous varient selon les espèces bactériennes. Par exemple, lors de la biosynthèse de la pénicilline, l'oxygène dissous est généralement maintenu à environ 30 % de la saturation en air. Si l'oxygène dissous chute à zéro et reste à ce niveau pendant cinq minutes, la formation du produit peut être fortement compromise. Si cette situation persiste pendant 20 minutes, des dommages irréversibles peuvent survenir.
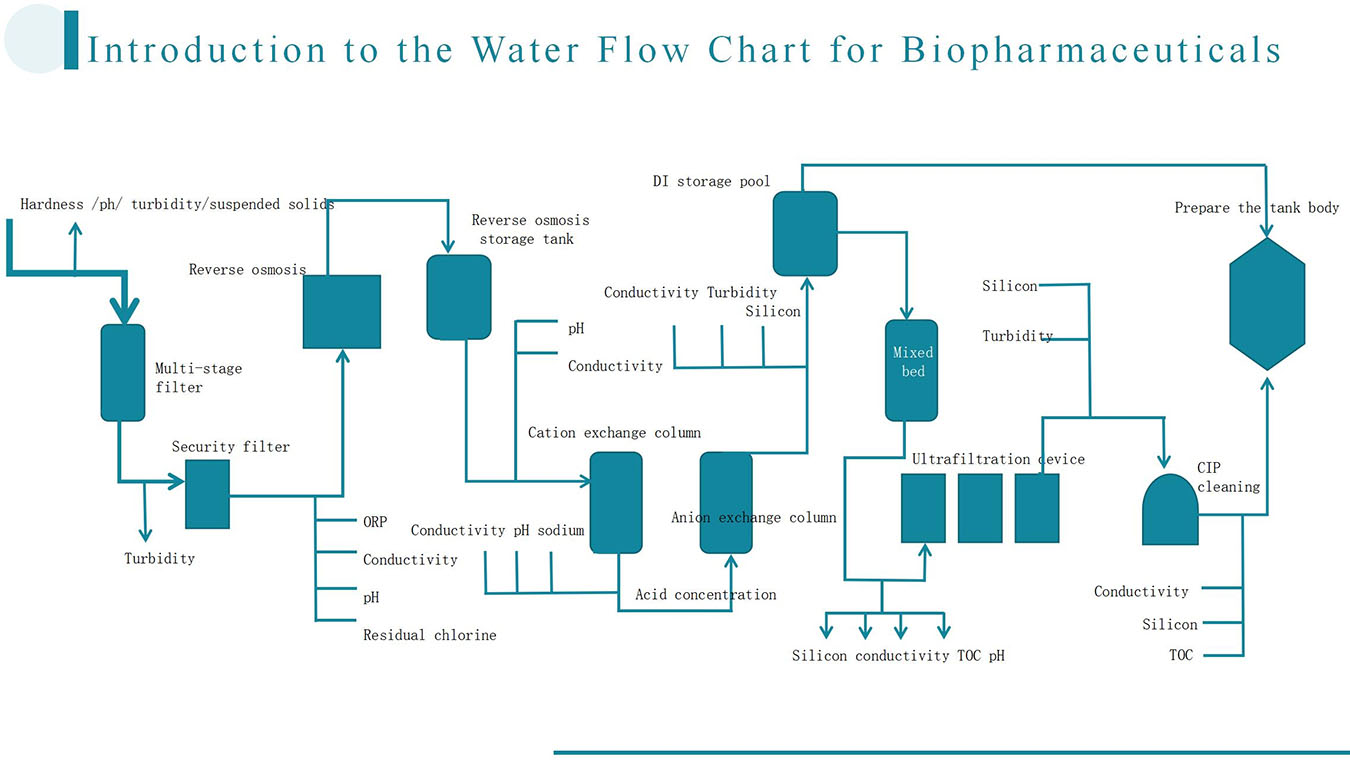
Actuellement, les capteurs d'oxygène dissous (OD) les plus couramment utilisés ne mesurent que la saturation relative en air, et non la concentration absolue d'oxygène dissous. Après stérilisation du milieu de culture, une aération et une agitation sont effectuées jusqu'à stabilisation de la mesure, la valeur étant alors fixée à 100 % de saturation en air. Les mesures ultérieures, réalisées pendant la fermentation, sont basées sur cette valeur de référence. Les valeurs absolues d'OD ne peuvent être déterminées avec des capteurs standard et nécessitent des techniques plus avancées, telles que la polarographie. Toutefois, les mesures de saturation en air sont généralement suffisantes pour le suivi et le contrôle des processus de fermentation.
Au sein d'un fermenteur, les concentrations d'oxygène dissous (OD) peuvent varier selon les zones. Même lorsqu'une valeur stable est obtenue en un point donné, des fluctuations peuvent persister dans certains milieux de culture. Les fermenteurs de grande taille présentent généralement des variations spatiales plus importantes des concentrations d'OD, ce qui peut affecter significativement la croissance et la productivité microbiennes. Des études expérimentales ont montré que, malgré une concentration moyenne d'OD de 30 %, les performances de fermentation en conditions fluctuantes sont nettement inférieures à celles obtenues en conditions stables. Par conséquent, lors du passage à l'échelle supérieure des fermenteurs, au-delà des considérations de similitude géométrique et de puissance, la minimisation des variations spatiales d'OD demeure un objectif de recherche primordial.
Pourquoi la surveillance de l'oxygène dissous est-elle essentielle dans la fermentation biopharmaceutique ?
1. Maintenir un environnement de croissance optimal pour les micro-organismes ou les cellules
La fermentation industrielle fait généralement intervenir des micro-organismes aérobies, tels qu'Escherichia coli et les levures, ou des cellules de mammifères, comme les cellules CHO (ovaires de hamster chinois). Ces cellules jouent un rôle essentiel au sein du système de fermentation, nécessitant de l'oxygène pour la respiration et leur activité métabolique. L'oxygène sert d'accepteur final d'électrons dans la respiration aérobie, permettant la production d'énergie sous forme d'ATP. Un apport insuffisant d'oxygène peut entraîner l'asphyxie cellulaire, l'arrêt de la croissance, voire la mort cellulaire, conduisant finalement à l'échec de la fermentation. Le contrôle des niveaux d'oxygène dissous (OD) garantit que les concentrations d'oxygène restent dans la plage optimale pour une croissance et une viabilité cellulaires durables.
2. Afin d'assurer une synthèse efficace des produits cibles
L'objectif de la fermentation biopharmaceutique n'est pas seulement de favoriser la prolifération cellulaire, mais aussi de faciliter la synthèse efficace des produits cibles souhaités, tels que l'insuline, les anticorps monoclonaux, les vaccins et les enzymes. Ces voies de biosynthèse nécessitent souvent un apport énergétique important, provenant principalement de la respiration aérobie. De plus, de nombreux systèmes enzymatiques impliqués dans la synthèse des produits dépendent directement de l'oxygène. Une carence en oxygène peut perturber ces voies métaboliques ou en réduire l'efficacité.
De plus, les niveaux d'oxygène dissous agissent comme un signal de régulation. Des concentrations d'oxygène dissous excessivement élevées ou faibles peuvent :
- Modifier les voies métaboliques cellulaires, par exemple en passant de la respiration aérobie à la fermentation anaérobie moins efficace.
- Déclencher des réponses au stress cellulaire, entraînant la production de sous-produits indésirables.
- Influencer les niveaux d'expression des protéines exogènes.
En contrôlant précisément les niveaux d'oxygène dissous à différentes étapes de la fermentation, il est possible d'orienter le métabolisme cellulaire vers une synthèse maximale du produit cible, permettant ainsi une fermentation à haute densité et à haut rendement.
3. Pour prévenir une carence ou un excès d'oxygène
Le manque d'oxygène (hypoxie) peut avoir de graves conséquences :
- La croissance cellulaire et la synthèse des produits cessent.
- Le métabolisme bascule vers des voies anaérobies, entraînant l'accumulation d'acides organiques tels que l'acide lactique et l'acide acétique, qui abaissent le pH du milieu de culture et peuvent empoisonner les cellules.
- Une hypoxie prolongée peut causer des dommages irréversibles, la récupération étant incomplète même après le rétablissement de l'apport en oxygène.
Un excès d'oxygène (sursaturation) présente également des risques :
- Cela peut induire un stress oxydatif et la formation d'espèces réactives de l'oxygène (ROS), qui endommagent les membranes cellulaires et les biomolécules.
- Une aération et une agitation excessives augmentent la consommation d'énergie et les coûts d'exploitation, entraînant un gaspillage inutile de ressources.
4. En tant que paramètre critique pour la surveillance en temps réel et le contrôle par rétroaction
L'oxygène dissous (OD) est un paramètre continu, complet et en temps réel qui reflète les conditions internes du système de fermentation. Les variations de son niveau permettent d'indiquer avec précision différents états physiologiques et opérationnels.
- La croissance cellulaire rapide augmente la consommation d'oxygène, ce qui entraîne une baisse des niveaux d'oxygène dissous.
- L'épuisement ou l'inhibition du substrat ralentit le métabolisme, réduisant la consommation d'oxygène et provoquant une augmentation des niveaux d'oxygène dissous.
- La contamination par des micro-organismes étrangers modifie le profil de consommation d'oxygène, entraînant des fluctuations anormales de la concentration en oxygène dissous et servant de signal d'alerte précoce.
- Des dysfonctionnements d'équipement, tels qu'une panne d'agitateur, un blocage du tuyau de ventilation ou un encrassement du filtre, peuvent également entraîner un comportement anormal de l'oxygène dissous.
En intégrant la surveillance en temps réel de l'oxygène dissous dans un système de contrôle automatisé par rétroaction, une régulation précise des niveaux d'oxygène dissous peut être obtenue grâce à des ajustements dynamiques des paramètres suivants :
- Vitesse d'agitation : L'augmentation de la vitesse favorise le contact gaz-liquide en brisant les bulles, améliorant ainsi l'efficacité du transfert d'oxygène. C'est la méthode la plus couramment utilisée et la plus efficace.
- Taux d'aération : Ajustement du débit ou de la composition du gaz d'entrée (par exemple, augmentation de la proportion d'air ou d'oxygène pur).
- Pression dans le réservoir : L'augmentation de la pression accroît la pression partielle d'oxygène, améliorant ainsi la solubilité.
- Température : L'abaissement de la température augmente la solubilité de l'oxygène dans le milieu de culture.
Recommandations de produits de BOQU pour la surveillance en ligne de la fermentation biologique :
Date de publication : 16 septembre 2025